威斯津生物的全球首款EB病毒相关肿瘤mRNA治疗性疫苗,获国家批准开展临床试验
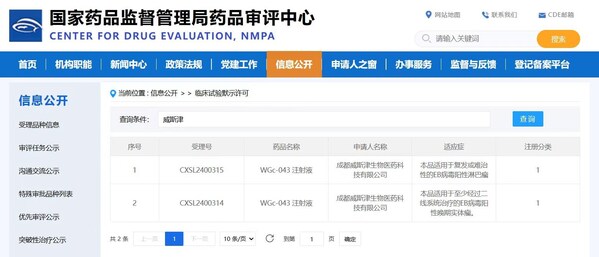
导言:8月6日,成都威斯津生物医药科技有限公司(威斯津生物)自主研发的"WGc-043注射液",其新药研究申请(IND)获得中国国家药品监督管理局(NMPA)药品审评中心(CDE)批准,收到国家药监局核准签发的《药物临床试验批准通知书》,可以开展I期临床试验。
8月6日,成都威斯津生物医药科技有限公司(威斯津生物)自主研发的"WGc-043注射液",其新药研究申请(IND)获得中国国家药品监督管理局(NMPA)药品审评中心(CDE)批准,收到国家药监局核准签发的《药物临床试验批准通知书》,可以开展I期临床试验。"WGc-043注射液"是全球首个中美双报均获批IND的治疗EB病毒相关肿瘤的mRNA疫苗。
mRNA肿瘤治疗性疫苗是目前mRNA创新药领域和肿瘤免疫疗法的重大突破口之一。默沙东(MSD)、莫德纳(Moderna)、拜恩泰克(BioNTech)等国际知名制药企业,在该领域均有密集布局,研发进展不一。威斯津生物的肿瘤治疗性疫苗管线"WGc-043注射液"此次获批IND,进一步验证了其在递送载体、序列设计等mRNA核心技术上的成熟性,也加速了全球高效低毒的抗肿瘤mRNA疫苗的商业化进程。
威斯津生物的全球首款EB病毒相关肿瘤mRNA治疗性疫苗,获国家批准开展临床试验
EB病毒相关肿瘤患者,可以选择的全新免疫治疗方案
WGc-043 mRNA疫苗已于今年5月在美国获批IND,中美批准的适应症均为EB病毒阳性肿瘤:一是适用于经过二线系统治疗的EB病毒阳性晚期实体瘤成人患者;二是适用于复发或难治性的EB病毒阳性血液瘤成人患者。WGc-043,可为终末期EB病毒阳性实体瘤和血液瘤患者提供全新的mRNA免疫治疗方案选择。
"接下来,我们将在国内开展临床试验,推动WGc-043 mRNA疫苗尽早商业化使用。"威斯津生物联合创始人兼总经理宋相容教授介绍说,鉴于有前期高质量试验数据的支持,WGc-043 mRNA疫苗有信心在临床试验中,表现出优秀的安全性和抗肿瘤活性。
颠覆性技术压舱,WGc-043 mRNA疫苗技术在先进性和突破性上亮点显著
WGc-043是威斯津生物在mRNA疫苗领域布局的20余个研发管线之一。该项目及其平台技术,在科技部主办的"2022年全国颠覆性技术创新大赛总决赛"中获得最高奖项(优胜奖),被认为具有"革命性、颠覆性"的创新和突破,是"可改变游戏规则"的创新性技术,一举突破了mRNA领域的全球专利封锁和技术壁垒。该项目技术的先进性和突破性体现在以下两方面:
1)通过人工智能实现高效能抗原筛选,优选出最为广谱安全的蛋白序列,mRNA分子中引入了全球原创设计的免疫增强子(IE),该设计使得WGc-043可充分激活患者自体的抗肿瘤免疫,在体内生成杀伤肿瘤的细胞毒性T细胞(cytotoxic T cells,CTLs)、抗原特异性抗体以及记忆性T细胞,具有相当于联合抗癌CAR-T和单克隆抗体的高效抗癌效果,还可避免肿瘤复发。
2)WGc-043的递送载体为全新自主研发,目前已在中国、美国、欧洲、加拿大、澳大利亚和南非等获得专利授权。全新的LNP递送系统的安全性和递送效率,已在威斯津自研的3个品种的临床试验中,得到了充分的验证。
市场潜力巨大,两类肿瘤有望实现mRNA免疫疗法"0"的突破
EB病毒被国际癌症研究机构(IARC)确定为第一类致癌物,在全球人群中的感染率超过90%,是首个被发现的人类致瘤病毒。EB病毒与10多种恶性肿瘤如鼻咽癌、淋巴瘤、胃癌、肺癌、肝癌、食管癌、乳腺癌、宫颈癌等高度相关,WGc-043获批适应症患者为EB病毒阳性的实体瘤和血液瘤成人患者,其定位市场的潜力巨大。
WGc-043已完成了针对鼻咽癌和自然杀伤T细胞淋巴瘤两个适应症的IIT(研究者发起的临床试验),展现出比现有公开的其它mRNA肿瘤治疗性疫苗更优越的安全性和有效性。可以预见,一旦WGc-043成功上市,将在EB病毒阳性的实体瘤和血液瘤这两类肿瘤中,实现mRNA免疫疗法"0"的突破。
免责声明:
※ 以上所展示的信息来自媒体转载或由企业自行提供,其原创性以及文中陈述文字和内容未经本网站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本网站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。如果以上内容侵犯您的版权或者非授权发布和其它问题需要同本网联系的,请在30日内进行。
※ 有关作品版权事宜请联系中国企业新闻网:020-34333079 邮箱:cenn_gd@126.com 我们将在24小时内审核并处理。
 更多新闻,请关注
更多新闻,请关注标签 :
相关网文
一周新闻资讯点击排行