三生制药公布2020年度业绩,综合平台优势助力业绩稳健增长
导言:中国领先的生物制药公司三生制药今天公布2020年全年业绩:在新冠疫情带来的巨大挑战之下,公司保持稳健的盈利,同时迎来了新的发展里程碑。
三生制药(01530.HK)今天公布2020年全年业绩:在新冠疫情带来的巨大挑战之下,公司保持稳健的盈利,同时迎来了新的发展里程碑。再次印证了三生制药多年积淀的中国生物制药龙头地位,也体现出公司强劲的发展活力。
核心产品业绩保持稳健
2020年,尽管受到新冠疫情的影响,三生制药仍凭借多年市场验证的雄厚实力保持业绩坚挺。根据IQVIA发布的2020年12月国内药企前200位名单,三生制药由去年的第28名跃升至第16名,上升12位。公司全年共实现营业收入人民币约55.88亿元,比去年同期增长5.1%;毛利约人民币45.25亿元,比去年同期增长3%;同口径正常化归母净利润14.16亿元,比去年同期增长5.3 %;研发投入5.9亿元,占营业收入10.6%。2020年7月22日,三生国健正式登陆上海证券交易所科创板。三生制药MSCI(明晟) ESG评级2020年被评为A级,超越全球78%生物科技公司。
三生制药多款核心产品保持稳健的内生“造血”能力。根据IQVIA、CAP数据,用于治疗血小板减少症的特比澳在2020年销售额27.63亿元再创新高,同比增长18.9%;公司两种重组人促红素产品益比奥和赛博尔销售额跃升至9.74亿元,同比大幅增长30%;用于治疗类风湿性关节炎、强直性脊柱炎及银屑病的益赛普销售额6.15亿元;蔓迪销售额3.68亿元,同比增幅高达46.9%。总体而言,几款核心产品市场占有率仍稳居头把交椅。与欧美相比,国内生物药存在较大的临床需求和市场潜力。公司正在积极调整优化市场策略,以巩固产品的领导地位。
2020年三生制药旗下共有三款产品的上市申请获得批准或受理。6月19日,三生制药旗下附属公司三生国健自主研发的注射用伊尼妥单抗(商品名:赛普汀)正式获得国家药品监督管理局(NMPA)批准上市并于同年纳入医保,获批的首个适应症为和化疗联合用于治疗HER2阳性的转移性乳腺癌。该产品获批仅12天后即在全国五省市开出首张处方。根据中国女医师协会乳腺疾病研究中心发布的《中国进展期乳腺癌共识指南2020(CABC3)》,伊尼妥单抗(赛普汀)成为进展期乳腺癌治疗优选方案之一。根据国卫办医函〔2020〕1047号,伊尼妥单抗已纳入《新型抗肿瘤药物临床应用指导原则(2020年版)》。8月19日,三生制药自主研发的那曲肝素钙注射液获得NMPA批准上市。8月26日,TLC授权三生制药在中国大陆商业化的两性霉素B脂质体注射剂Ampholipad™上市申请获NMPA受理。
在2020年国家医保目录调整中,年度重磅新产品赛普汀获准首次纳入其中,此外公司核心产品特比澳也通过谈判进入新版医保目录。
在研管线加速推进
2020年,公司继续立足研发创新,目前拥有34项在研产品,其中24种国家新药,涵盖肿瘤科12项、自身免疫性疾病及其他疾病14项。其中预充式益赛普水针剂301S已向国家药监局申请生产批件并获受理。
2020年公司新增三项临床试验批准,其中611抗IL4Rα抗体获得FDA和NMPA临床试验批准,用于治疗特应性皮炎;610抗IL5抗体获得NMPA临床试验批准,用于治疗重度嗜酸性粒细胞性哮喘。
各重磅靶点在研产品临床试验有序推进:610对健康志愿者进行的剂量递增I期临床试验已经完成;611对健康志愿者进行的剂量递增I期临床试验正在美国进行,计划最近在中国启动;抗CD20抗体健妥昔304R已完成与利妥昔单抗在零肿瘤负荷非霍奇金淋巴瘤患者的安全性及药代动力学方面的I期头对头对比临床试验;用于治疗多种癌症的抗PD1抗体609A美国I期临床试验完成患者入组,中国I期临床试验患者入组进行中;抗IL-17A抗体608已完成健康志愿者剂量递增的I期临床试验,将在近期开展用于斑块状银屑病患者II期临床试验;抗VEGF抗体601A用于AMD和糖尿病视网膜黄斑水肿病变患者的剂量递增的I期临床已完成,并已启动用于视网膜分支阻塞及视网膜中央静脉阻塞患者的II期临床试验;人源化抗TNFα抗体SSS07对健康志愿者和RA患者的I期临床试验已完成;抗EGFR抗体602用于健康志愿者和结直肠癌患者的I期临床试验已完成,并已启动该产品用于结直肠癌患者的II期临床试验; 治疗贫血的HIF117已开始I期临床试验患者入组。
已上市产品的新剂型、新适应症、新一代产品的临床研究取得显著进展:预充式益赛普水针剂已向NMPA递交生产申请并获受理;特比澳用于儿童ITP的III期临床试验已开始患者招募,该产品用于有血小板减少风险的肝功能障碍患者在围手术期的动员的I期临床试验已完成;治疗贫血的两款长效促红素SSS06已完成II期临床试验的患者招募,RD001的II期临床试验患者招募正在进行;在男性脱发患者中头对头比较米诺地尔泡沫剂型MN709与Rogaine的III期研究已完成患者招募。
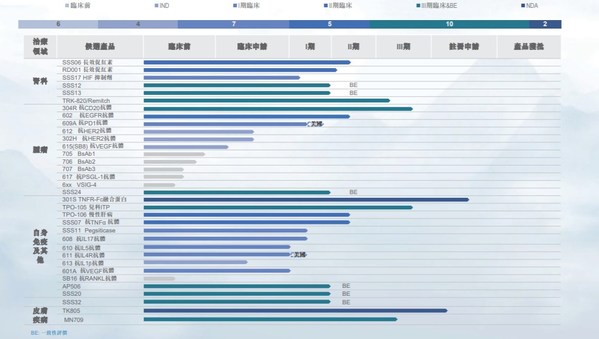
截止2020三生制药研发管线外部合作项目及临床试验进展顺利:
日本东丽授权的治疗血液透析患者瘙痒症的TRK-820完成III期临床桥接试验第一部分研究;治疗高尿酸水平的顽固型痛风的SSS11 pegsiticase目前正在I期临床试验,合作伙伴Selecta已开始包含pegsiticase的组合疗法SEL-212用于慢性难治性痛风的三期临床试验,并向三生制药支付400万美元里程碑付款。三生国健选取合作伙伴Verseau旗下抗VSIG-4单抗作为第二个授权产品。
极具竞争力的体系化平台优势
放眼未来,三生制药将继续保持集研发、生产、营销、投资合作为一体的平台优势,巩固其在中国生物制药行业的领先地位,并通过专注开发创新的生物制药产品,解决未被满足的医疗需求,造福更多患者。
公司将充分整合多个研发平台超过500人的研发团队,积极布局包括单克隆抗体产品、双特异性抗体、抗体融合蛋白及多个小分子药物等创新疗法,从而为患者带来多种治疗方案。预计12个月内将有多个具备同类首创或同类最优潜力的在研产品在中美提交临床申请。
公司拥有约38,000升产能的单克隆抗体设施和哺乳动物细胞、细菌及小分子生产设施,以及在生物医药制造领域超过28年的经验。凭借符合国际质量标准的规模化生产能力,持续向市场提供高质量的生物药产品。拥有3200逾名专业销售人员,覆盖超过2500家三级医院及超过14,000家二级及以下医院,业务遍及全国。营销实力近三十年来得到市场验证和认可,为公司持续增长提供保障。
三生制药董事长娄竞博士表示:“自1993年成立以来,三生制药已走过28年的发展历程。2020年是我们经历新冠疫情考验的一年,也是焕发新生机的一年。公司积极向疫区供应急需药品,为国家持续抗疫做出贡献。同时凭借多年实践验证的研产销一体综合平台优势,公司业绩保持稳健的发展势头。2020年,我们迎来了乳腺癌新产品赛普汀的问世,同时也在A股资本市场开启了新的旅程。每一步的里程碑,都是对公司作为创新生物药企业的肯定。面对机遇与挑战并存的行业环境,三生制药将聚焦核心治疗领域,继续深挖未满足的医疗需求。加大对开发创新生物药产品的投入,通过后续管线的组合策略充分发挥现有产品的优势,同时大力推动重磅靶点的研发进程。保持稳健增长的同时不断补充新鲜血液,实现公司可持续发展,为人类健康造福。”
警示说明及前瞻性陈述
本新闻稿包含前瞻性陈述,例如涉及业务和产品前景,或公司的意图、计划、认知、预期及策略。该等前瞻性陈述是根据本公司现有的资料,并按本新闻稿发布时的展望陈述。该等前瞻性陈述基于若干预测、假设及前提,其中一些是主观性的或不受我们控制。该等前瞻性陈述可能被证明是不正确的,或将来可能无法实现。就任何新产品或产品的新适应症, 我们无法确保其将能成功开发或最终上市销售。该等前瞻性陈述受各种风险及不明朗因素影响。我们的其他公开披露文件可能提供该等风险及不明朗因素的更多信息。所涉及之科学信息可能只是初步的和研究性的。本公司股东及潜在投资者在买卖本公司股份时,请务必谨慎行事。
免责声明:
※ 以上所展示的信息来自媒体转载或由企业自行提供,其原创性以及文中陈述文字和内容未经本网站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本网站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。如果以上内容侵犯您的版权或者非授权发布和其它问题需要同本网联系的,请在30日内进行。
※ 有关作品版权事宜请联系中国企业新闻网:020-34333079 邮箱:cenn_gd@126.com 我们将在24小时内审核并处理。
 更多新闻,请关注
更多新闻,请关注标签 :
相关网文
一周新闻资讯点击排行